بازدید امروز :72
بازدید دیروز :60
کل بازدید :500918
تعداد کل یاداشته ها : 80
04/4/29
12:19 ع

تفاوت های شگفت انگیز گرافیت و الماس
آلوتروپی ها فرم های از یک عنصر هستند که بصورت اتمی یا مولکولی ( جور هسته ) در طبیعت وجود دارند. معروف ترین آنها آلوتروپی های اکسیژن شامل O2 و O3 ( ازون ) می باشد.
آلوتروپی های یک عنصر دارای شباهت ها و تفاوت های زیادی هستند. جالب ترین آلوتروپی های موجود در طبیعت را می توان در کربن مشاهده کرد.
گرافیت: نرم، سیاه، رسانای الکتریسیته،نارسانای گرما، قابل تورق،
الماس: سخت، شفاف، نارسانای الکتریسیته، رسانای گرما،
بدیهی است از آنجایی که تنها اتم موجود در این دو ترکیب کربن است علت این تفاوت های شگفت آور را باید در ساختار آنها جستجو کرد.
در گرافیت کربن دارای هیبریداسیونSP2 است. بدین ترتیب زوایای پیوند *120، ساختار مسطح با واحد های شش گوشه ای که صفحات با پیوندهای ضعیف واندروالسی با یکدیگر متصل هستند. در این میان تک الکترون اربیتال شرکت نکرده در هیبریداسیون (Pz) امکان حرکت در فضای بین صفحات را دارد.
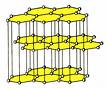
در الماس کربن دارای هیبریداسیونSP3 و بدین ترتیب زوایای پیوند *109 با ساختار هرمی منتظم.
در واقع الماس شبکه ای غول آسا از هرم های گسترش یافته در سه بعد است که در تعدادی از اتم ها با یکدیگر مشترک هستند.
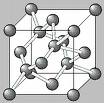
بدین ترتیب بر خلاف گرافیت تمامی پیوند ها در الماس کووالانسی بون الکترون آزاد می باشند.
با این توضیحات می توان براحتی خواص گرافیت و الماس را توصیف کرد
